Plasticité tumorale dans le mélanome

Objectifs
Le mélanome cutané est le type de cancer de la peau le plus agressif, dont les cellules cancéreuses présentent une plasticité exacerbée, qui contribue à l’hétérogénéité intra-tumorale et à la résistance au traitement.
Malgré les progrès récents apportés par les thérapies ciblées et les immunothérapies, un nombre important de patients atteints de mélanome métastatique présentent encore une résistance innée ou acquise.
De plus en plus de données suggèrent qu’en plus des altérations génétiques, le développement de la résistance peut être attribué aux adaptations phénotypiques dépendantes de processus transcriptionnels et épigénétiques.
Une meilleure compréhension des mécanismes de reprogrammation qui sous-tendent les adaptations phénotypiques des cellules de mélanome, leurs interactions complexes avec le microenvironnement et donc leur capacité exceptionnelle à développer une résistance aux stratégies thérapeutiques actuelles, est encore nécessaire pour définir de nouvelles cibles et concevoir de nouvelles combinaisons thérapeutiques.
Projets
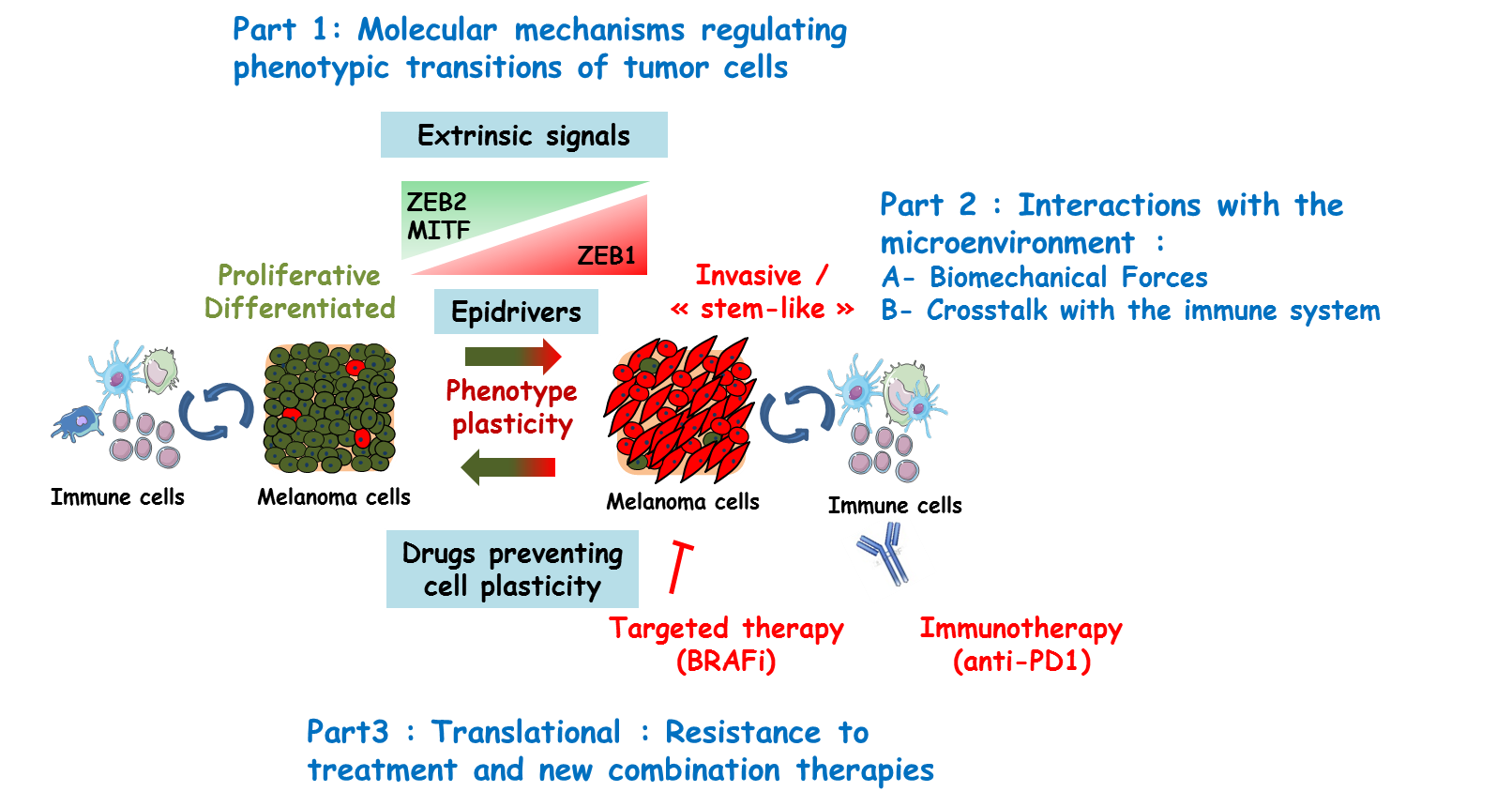
L’hétérogénéité intra-tumorale du mélanome repose sur un modèle de » changement de phénotype » selon lequel les cellules de mélanome passent d’un état prolifératif/différencié à un état invasif/de type souche. Le facteur de transcription associé à la mycrophtalmie (MITF), principal régulateur de la différenciation des mélanocytes, est un marqueur majeur du phénotype prolifératif, dont la perte dans les cellules de mélanome est suffisante pour induire une reprogrammation vers un phénotype invasif et “stem-like”. Dans ce contexte, nos travaux antérieurs ont démontré que les facteurs de transcription connus pour leur rôle dans la transition épithélio-mésenchymateuse (EMT) dans les carcinomes, jouent également un rôle majeur dans le mélanome. L’EMT est un processus majeur de plasticité des cellules cancéreuses, orchestré par un réseau de facteurs de transcription (EMT-TFs), incluant des membres des familles ZEB, SNAIL et TWIST, qui interagissent avec des régulateurs épigénétiques (Caramel et al, Cancer Res. 2018 ; Puisieux et al, Nat. Cell Biol. 2014). Nous avons récemment démontré que la reprogrammation de l’expression des EMT-TF régule la mélanomagenèse, la plasticité des cellules cancéreuses et la résistance adaptative aux thérapies ciblées (Caramel et al., 2013 ; Richard et al., 2016). En particulier, ZEB1 favorise la transition vers un phénotype avec une faible expression de MITF, présentant des similitudes avec les “cellules souches de la crête neurale” (NCSC). Nos données préliminaires suggèrent également que ZEB1 régule directement la tétraspanine 8 (Tspan8), une protéine transmembranaire que nous avons précédemment montrée comme un inducteur majeur du phénotype invasif (Agaësse et al., 2017a, 2017b, El Kharbili et al., 2017a, 2017b, 2019).
Si le rôle de la plasticité phénotypique des cellules cancéreuses dans l’émergence de résistance aux thérapies ciblées a été étudié en détail dans le mélanome, les conséquences sur l’échappement au système immunitaire et la réponse à l’immunothérapie restent encore mal caractérisées. Nos projets visent à mieux caractériser les mécanismes soutenant l’adaptation des mélanomes, considérés comme des écosystèmes complexes, et l’acquisition de résistance aux thérapies ciblées et immunothérapies. Forts de notre expertise dans le domaine du mélanome et de la plasticité des cellules cancéreuses et grâce à un solide réseau de collaborations (épigénétique, immunologie, biomécanique), nous utiliserons des méthodes innovantes dans des modèles in vitro et in vivo (souris, poisson medaka), ainsi que des cohortes d’échantillons humains, afin de :
- poursuivre l’étude des mécanismes moléculaires qui soutiennent la plasticité des cellules cancéreuses, y compris l’identification des réseaux transcriptionnels et des régulateurs épigénétiques ;
- analyser les forces biomécaniques in vivo pendant la transition vers l’état invasif ;
- caractériser les échanges des cellules tumorales avec leur microenvironnement immunitaire, les mécanismes d’évasion et de résistance immunitaire, incluant une caractérisation détaillée de l’hétérogénéité intra-tumorale dans des échantillons de patients ;
- élaborer des stratégies originales pour cibler la plasticité des cellules cancéreuses afin de vaincre la résistance du mélanome aux stratégies thérapeutiques actuelles, ce qui ouvrira la voie au développement de nouvelles combinaisons thérapeutiques pour le traitement du mélanome malin.
-
L'équipe "Plasticité tumorale dans le mélanome" est une équipe émergente co-dirigée par Julie Caramel, CRCN INSERM, et Stéphane Dalle, PU-PH, chef du service d'oncodermatologie de l'hôpital Lyon Sud (depuis 2017). Ils ont structuré depuis 2013, un groupe de recherche, centré sur le mélanome, rassemblant des chercheurs et cliniciens avec une expertise complémentaire sur cette pathologie cutanée. Ce groupe a été constitué au sein de l'équipe d'Alain Puisieux, spécialisée dans "l'EMT et la plasticité des cellules cancéreuses".
-
Julie Caramel, CRCN Inserm
julie.caramel@lyon.unicancer.fr
04.26.55.67.05Stéphane Dalle, PU-PH
stephane.dalle@chu-lyon.frCheney D, 2ème étage
Centre Léon Bérard