Résistance hormonale, méthylation et cancer du sein

Contexte et objectifs
Contexte
Le cancer du sein est une maladie hétérogène dans laquelle des altérations de gènes comme le récepteur aux oestrogènes ERa, le récepteur à la progestérone (PR) et HER2 impactent les caractéristiques cliniques de la maladie et la réponse des patientes aux thérapies ciblées. 80% des tumeurs primaires expriment ERα et les thérapies endocriniennes ont apporté un bénéfice notoire en termes de survie. Cependant 40% des patientes sont résistantes aux traitements. Par ailleurs, les tumeurs triple-négatives sont très agressives et il n’existe pas de thérapie ciblée.
Ce constat souligne un besoin urgent d’identifier de nouveaux acteurs de la tumorigenèse mammaire afin de proposer de nouveaux biomarqueurs de cette pathologie pour améliorer la prise en charges des patientes et leurs traitements. Récemment, il est apparu que d’autres récepteurs stéroïdiens pouvaient également jouer un rôle dans la tumorigenèse mammaire tels que le récepteur aux androgènes (AR) et le récepteur aux glucocorticoïdes (GR). Ces récepteurs ont des rôles opposés dans les tumeurs ERa positives et négatives soulevant une grande complexité dans leur mécanisme d’action. La présence de variants des récepteurs stéroïdiens est également à prendre en compte.
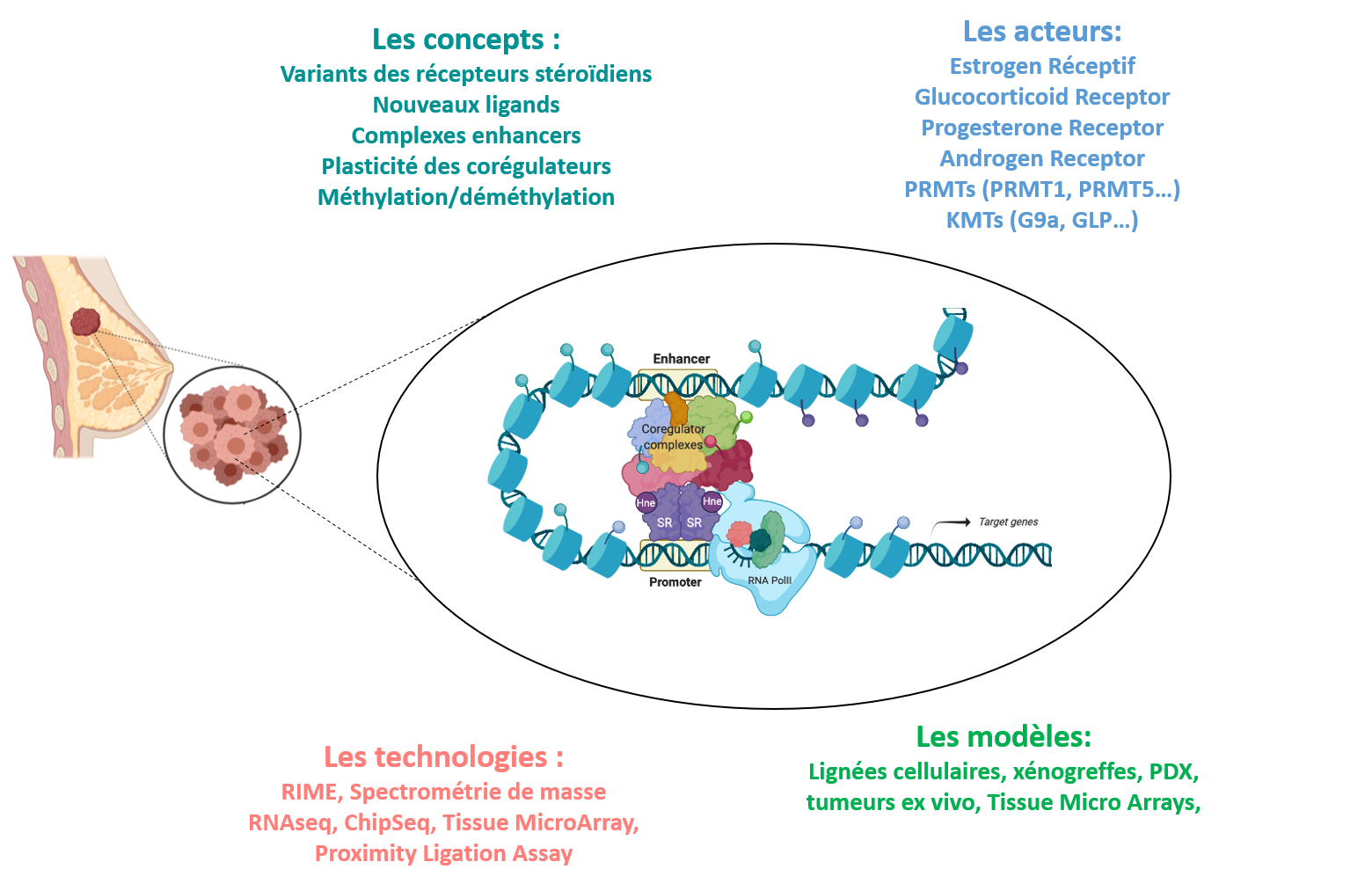
Les récepteurs stéroidiens sont des facteurs de transcription dont l’activité est régulée par la fixation des ligands. Classiquement, ils agissent en recrutant des protéines corégulatrices au niveau des régions promotrices de ses gènes cibles. Ces corégulateurs remodèlent la structure chromatinienne et induisent ou inhibent le recrutement et l’activation de l’ARN polymérase II.
D’autre part, l’activité transcriptionnelle des différents récepteurs et de leurs corégulateurs est hautement régulée par des modifications post traductionnelles telle que la méthylation des résidus lysines et arginines, impliquant des activités enzymatiques de lysine méthyltransférases (KMTs) et d’arginine méthyltransferases (PRMTs).
Cependant ces enzymes peuvent aussi modifier les histones, ajoutant un haut niveau de complexité. Ces enzymes surexprimées dans le cancer du sein présentent souvent des activités oncogéniques et des inhibiteurs spécifiques de leur activité enzymatique en font des cibles thérapeutiques prometteuses.
Objectifs
L’équipe « résistance hormonale, méthylation et cancer du sein » s’intéresse à décrypter les mécanismes moléculaires impliqués dans la résistance aux différents traitements afin de proposer de nouvelles cibles thérapeutiques et de nouvelles drogues adaptées aux différents sous-types de cancer du sein. La complémentarité entre les chercheurs et les cliniciens est un atout indéniable pour permettre de transférer les résultats obtenus au laboratoire vers une utilisation au profit des patientes.
Projets
Projet 1 : NESTOR
Comprendre comment PRMT5 régule l’activité transcriptionnelle des récepteurs stéroidiens dans les différents sous-types de tumeurs mammaires.
Projet 2 : METEOR
Cibler les PRMTs afin de sensibiliser les tumeurs mammaires aux thérapies conventionnelles.
Projet 3 : GLUCOCAN
Décrypter comment GR régule la tumorigenèse mammaire (formation de métastases et résistance à la chimiothérapie) : nouveaux ligands, nouveaux partenaires impliqués dans les complexes enhancers.
Projet 4 : ISOTHER
Developper une nouvelle thérapie anti-tumorale grâce à la production d’un ADC ciblant ERa36, un variant d’ERa exprimé à la membrane des cellules tumorales
-
Co-direction :
Muriel Le Romancer, DR2 INSERM
Muriel.leromancer@lyon.unicancer.fr
0478782822Olivier Trédan, Médecin oncologue, PH, CLB
Olivier.tredan@lyon.unicancer.frCheney D, 4ème étage
Centre Léon Bérard