Accueil > Hepatitis Viruses and Pathobiology of Chronic Liver Diseases > Axe 1 : Persistance et guérison de l’infection par le virus de l’hépatite B
Axe 1 : Persistance et guérison de l’infection par le virus de l’hépatite B
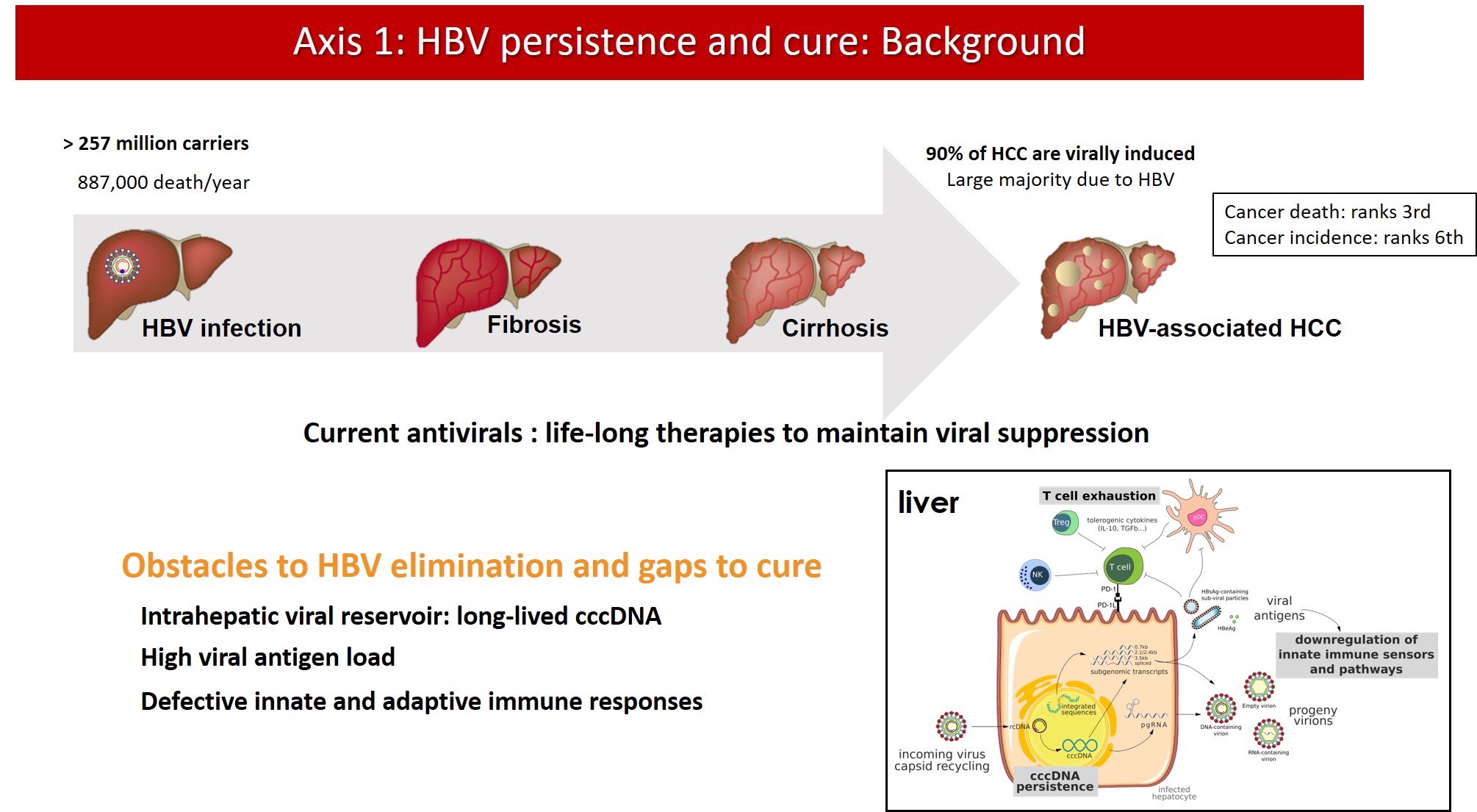
Contexte
Les traitements antiviraux actuels de l’hépatite B chronique permettent d’obtenir une suppression virale, c’est-à-dire de ramener la charge virale de l’ADN sérique du HBV en dessous de la limite de quantification chez la majorité des patients. Cependant, la production de protéines virales continue et un traitement à vie est nécessaire pour maintenir l’infection sous contrôle. En effet, les traitements antiviraux sont incapables d’éliminer l’ADNccc du noyau des hépatocytes infectés. L’ADNccc est enroulé sous forme de nucléosomes pour former une structure stable et chromatinisée qui est régulée par des mécanismes épigénétiques et est responsable de la persistance et du rebond viral après l’arrêt du traitement. De plus, la capacité du HBV à s’intégrer dans le génome de l’hôte empêche une « cure de stérilisation » complète. La réplication virale résiduelle, la production d’antigènes et la persistance de séquences virales intégrées chez la plupart des patients sous traitement contribuent largement au risque résiduel de CHC, même chez les patients dits ‘virosupprimés’.
De nouvelles approches thérapeutiques sont nécessaires pour surmonter la persistance du HBV dans les cellules infectées en éradiquant ou en réduisant au silence transcriptionnel l’ADNccc viral. Le développement de nouvelles combinaisons thérapeutiques basées sur des antiviraux à action directe et des approches immunomodulatrices nécessite la définition de nouveaux critères d’évaluation de l’efficacité du traitement ainsi que le développement et la validation de nouveaux biomarqueurs non invasifs du pool d’ADNcc intrahépatique.
Objectifs
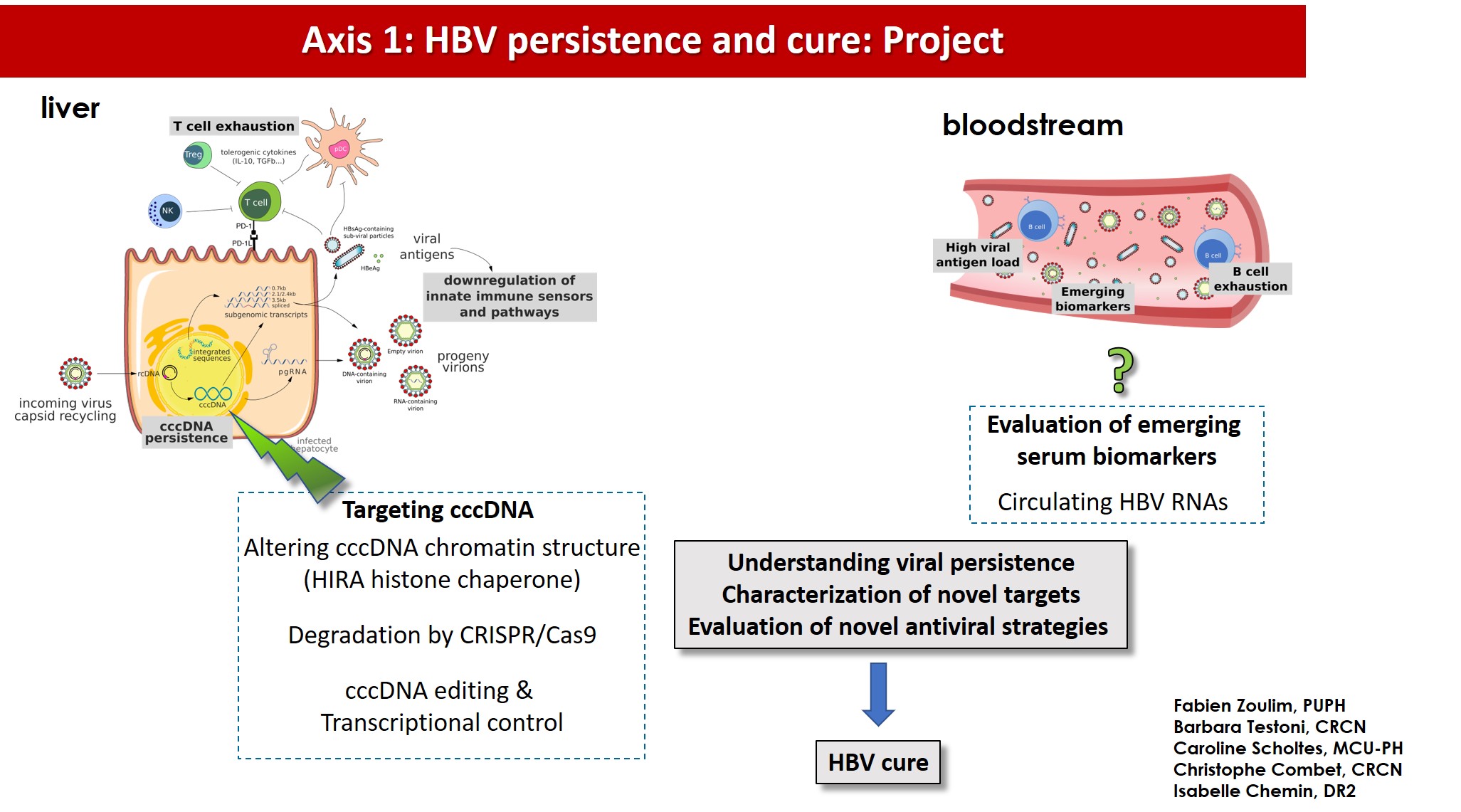
Dans ce contexte, nos objectifs spécifiques seront de :
1°) Générer de nouvelles connaissances sur la biologie de l’ADNccc, en particulier sur les étapes clés menant à sa formation et à sa régulation transcriptionnelle, in vitro et in vivo
2°) Identifier de nouvelles cibles ou approches pour dégrader ou réduire au silence l’ADNccc ;
3°) Caractériser et évaluer des biomarqueurs sériques de substitution non invasifs pour les quantités d’ADNccc intrahépatiques et l’activité transcriptionnelle in vitro et in vivo chez des patients mono-infectés par le HBV ou co-infectés par le HBV -HDV (projet RHU CirB-RNA) ;
4°) Evaluer de nouvelles approches thérapeutiques dans des modèles expérimentaux et dans des essais cliniques (programme ANRS ‘HBV cure’ et projet H2020 IPcureB).
5°) Evaluer l’impact de la variabilité des génomes du HBV et du HDV dans différentes régions du monde sur l’évolution des maladies du foie et les réponses aux thérapies.
Personnel permanent
Zoulim F (PU/PH), Testoni B (CRCN), Scholtès C (MCU/PH), Combet C (CRCN), Chemin I (DR2), P Dény (PUPH), M Michelet (IE), Dubois A (AI).
Publications
Chemin I, Pujol FH, Scholtès C, Loureiro CL, Amirache F, Levrero M, Zoulim F, Pérez-Vargas J, Cosset FL. Preliminary Evidence for Hepatitis Delta Virus Exposure in Patients Who Are Apparently Not Infected With Hepatitis B Virus. Hepatology. 2021 Feb;73(2):861-864.
Cohen D, Ghosh S, Shimakawa Y, Ramou N, Garcia PS, Dubois A, Guillot C, Kakwata-Nkor Deluce N, Tilloy V, Durand G, Voegele C, Ndow G, d’Alessandro U, Brochier-Armanet C, Alain S, Le Calvez-Kelm F, Hall J, Zoulim F, Mendy M, Thursz M, Lemoine M, Chemin I. Hepatitis B virus preS2Δ38-55 variants: A newly identified risk factor for hepatocellular carcinoma. JHEP Rep. 2020 Jul 11;2(5):100144.
Zoulim F, Lenz O, Vandenbossche JJ, Talloen W, Verbinnen T, Moscalu I, Streinu-Cercel A, Bourgeois S, Buti M, Crespo J, Manuel Pascasio J, Sarrazin C, Vanwolleghem T, Shukla U, Fry J, Yogaratnam JZ. JNJ-56136379, an HBV Capsid Assembly Modulator, Is Well-Tolerated and Has Antiviral Activity in a Phase 1 Study of Patients With Chronic Infection. Gastroenterology. 2020 Aug;159(2):521-533.e9.
Stadelmayer B, Diederichs A, Chapus F, Rivoire M, Neveu G, Alam A, Fraisse L, Carter K, Testoni B, Zoulim F. Full-length 5’RACE identifies all major HBV transcripts in HBV-infected hepatocytes and patient serum. J Hepatol. 2020 Jul;73(1):40-51.
Testoni B, Lebossé F, Scholtes C, Berby F, Miaglia C, Subic M, Loglio A, Facchetti F, Lampertico P, Levrero M, Zoulim F, Serum hepatitis B core-related antigen (HBcrAg) correlates with covalently closed circular DNA transcriptional activity in chronic hepatitis B patients. J Hepatol 2019. 70:615-625.
Lebossé F, Testoni B, Fresquet J, Facchetti F, Galmozzi E, Fournier M, Hervieu V, Berthillon P, Berby F, Bordes I, Durantel D, Levrero M, Lampertico P, Zoulim F, Intrahepatic innate immune response pathways are downregulated in untreated chronic hepatitis B. J Hepatol 2017. 66:897-909.
Boyd A, Lacombe K, Lavocat F, Maylin S, Miailhes P, Lascoux-Combe C, Delaugerre C, Girard PM, Zoulim F. Decay of ccc-DNA marks persistence of intrahepatic viral DNA synthesis under tenofovir in HIV-HBV co-infected patients. J Hepatol 2016, 65:683-691.